KIMIA KELAS X
Perkembangan Teori ATOM
29 - Oktober - 2021 14,2K Share :Kamu telah mengetahui beberapa unsur dalam kehidupan sehari - hari. Unsur dapat mengalami perubahan materi berupa perubahan kimia. Perubahan kimia ini disebabkan oleh partikel - partikel terkecil dari unsur tersebut. Partikel - partikel terkecil inilah yang dikenal sebagai atom.

Kamu telah mengetahui beberapa unsur dalam kehidupan sehari - hari. Unsur dapat mengalami perubahan materi berupa perubahan kimia. Perubahan kimia ini disebabkan oleh partikel - partikel terkecil dari unsur tersebut. Partikel - partikel terkecil inilah yang dikenal sebagai atom.
Daftar Isi :
A. Perkebangan Teori Atom
Bagilah sebutir beras menjadi dua bagian, kemudian dibagi lagi menjadi dua dan seterusnya hingga beras tidak dapat dibagi lagi. Bagian terkecil dari beras yang tidak dapat dibagi inilah yang menjdi awal mula berkembangnya konsep dari atom.
Konsep atom dikemukakan oleh Demokritos. Namun konsep atom ini tidak didukung ileh eksperimmen yang meyakinkan. Oleh karena itu, konsep tersebut tidak dapat diterimma oleh beberapa ahli ilmu pengetahuan dan filsafat.
pengembangan konsep - konsep atom secara ilmiah dimulai dari Jhon Dalton (1805). Eksperimen dilanjutkan oleh Thomson (1897), Rutherford (1914).
Eksperimen yang memperkuat konsep atom ini menghasilkan gambaran mengenai susunan partikel -partikel didalam atom. Gambaran ini berfungsi untuk memudahkan dalam memahami sifat - sifat kimia suatu atom. Gambaran susunan partikel - partikel dasar dalam atom disebut model atom.
1. Model atom Dalton
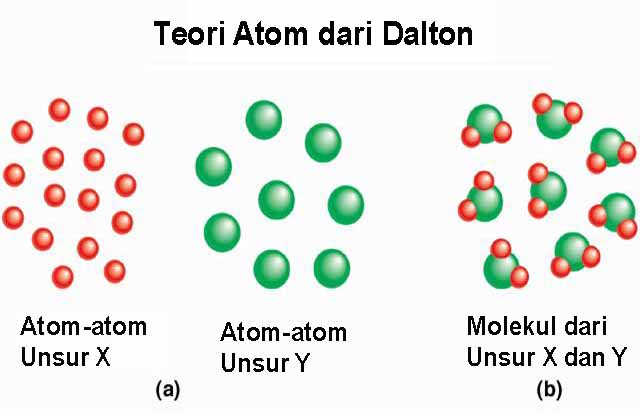
John Dalton adalah seorang ilmuwan Inggris pada abad pertengahan menggunakan konsep atom untuk menjelaskan reaksi-reaksi kimia. Menurutnya, reaksi kimia terjadi akibat penggabungan dan pemisahan atomatom. Jumlah atom-atom yang terlibat dalam reaksi kimia adalah tertentu dan persenyawaan serta pemisahan atom-atom tersebut memenuhi hukum perbandingan tertentu yang tetap.
Pokok - pokok teori atom yang di kemukakan oleh Dalton Sebagai berikut :
- Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi.
- Atom digambarkan sebagai bola pejal yang sangat kecil. Suatu unsur memilki atom - atom yang identik dan berbeda untuk unsur yang berbeda.
- Atom - atom bergabung membentuk seyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air yang terdiri dari atom - atom hidrogen dan atom - atom oksigen.
- Reaksi kimia merupakan pemisahan atau penggabungan kembali atom - atom. Suatu atom tidak dapat diciptakan atau dimusnahkan serta diubah menjadi atom unsur lain pada suatu reaksi.
2. Model Atom Thomson

J.J. Thompson, pada pertengahan abad 19 atau tepatnya pada tahun 1858, J. J. Thompson melakukan percobaan dengan menggunakan tabung lucutan yang menghasilkan sinar katoda. Sinar ini ternyata bermuatan listrik karena dapat dibelokkan oleh medan listrik maupun medan magnet.
Menurut Thomson, atom merupkan boe pejal bermuatan positif. sementara itu, elektron (bagian atom yang bermuatan negatif) tersebar merata dipermukaan bola tersebut. Jumlah muatan positif sama dengan jumlah muatan negatif sehingga atom bersifat netral. Muatan - muatan negatif tersebut tersebar seperti kismis pada roti kismis.
3. Model Atom Rutherford
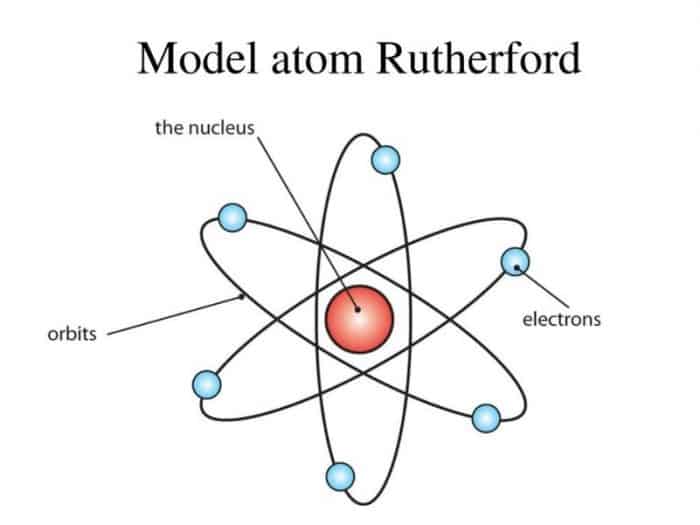
Menurut Rutherford, atom merupakan bola berongga yang tersusun dari inti atom dan elektron yang mengililinginya. Inti atom mermuatan positif dan massa atom terpusat pada inti atom. Sebagian besar atom merupakan ruang kosong. Besarnya muatan possitif berbeda antara satu atom dengan atom yang lainnya. Jumlah muatan positif pada inti atom sama dengan jumlah elektron disekitar inti atom. Oleh karena itu, atom bersifat netral.
Model atom Rutherford mempunyai kelemahan. Kelemahan dari Rutherford yaitu tidak dapat menjelaskan mengapa elektron tidak jatuh kedalam inti atom. Berdasarkan teori fisika, elektron disekitar inti atom saling tarik menarik dengan inti atom. Hal ini disebabkan inti atom bermuatan positif dan elektron bermuatan negatif.
4. Model Atom Niels Bohr
Pada tahun 1912, ketika Neils Bohr (1885-1962) menjadi mahasiswanya Rutherford di Manchester of University. Bohr mengetahui bahwa model orbital ini, meskipun sangat menarik, bukan tidak terkoreksi sama sekali, karena tidak dapat menjelaskan, seperti misalnya, mengapa seluruh atom hidrogen mempunyai sifat kimia yang identik.
Niels Bohr mengemukakan teori tentang atom sebagai berikut :
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif didalam suatu lintasan.
- Elektron - elektron berkedudukan pada tingkat - tingkat energi tertentu yang disebut kulit - kulit elektron.
- Elektron mempunyai set orbit yang disebut kondisi stasiner. Elektron yang berada pada orbitnya selalu mempuyai energi yang tetap. Elektron juga tidak memancarkan energi apapun.
- Elektron dapat berpindah lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang.
Jika elektron berpindah lintasan ke lintasan yang lebih tinggi, elektron akan menyerap energi. Jika elektron berpindah ke lintasan yang lebih rendah, elektron akan memancarkan energi.
5. Model Atom Modern
Pengertian atom modern disebut juga sebagai teori atom mekanika kuantum atau mekanika gelombang. Model atom modern ini berkaitan dengan mempelajari tentang kimia dasar dan memahami sifat – sifat materi kimia dasar dengan mudah.
Model atom modern didasarkan pada tiga pendapat ahli sebagai berikut :
- Broglie (1924) menyatakan bahwa elektron bersifat gelombang dan partikel.
- Heisenberg (1927) mengemukakan asas ketidak pastian.
- Scrodinger (1927) mengemukakan tentang persamaan gelombang elektron dalam atom.
Ketiga pendapat tersebut menghasilkan kesimpulan tentang model atom modern. model atom modern menyatakan bahwa kulit - kulit elektron bukan yang keduduakan yang pasti dari suatu elektron. Kulit - kulit elektron hanyalah suatu kebolehjadiannya saja.
Sumber
*) Dikutip dari berbagai sumber

Andi Tedy
Content Editor